丂丂丂丂丂丂丂丂丂丂丂丂斀墳懍搙榑 偺幚尡
丂丂侾丏丂帪寁斀墳丗
丂丂丂帋栻傪崿崌偟偨偺偪丄偁傞堦掕偺帪娫傪宱夁偟偰 偦偺斀墳偑姰寢偡傞傕偺偺
幚尡傪峴側偆丅
丂丂乮侾乯丂儊僠儗儞僽儖乕偺扙怓幚尡丗
丂丂仠丂侽丏係倣倧倢/倢 俶倎俷俫丂俆侽倣倢丄 僌儖僐乕僗乮C6H12O6丄僽僪僂摐乯
侽丏俈俆倗丂傪 僼儔僗僐偵擖傟丄侾亾 儊僠儗儞僽儖乕塼傪 俀亅俁揌 壛偊丄僑儉愷傪偟偰 俁丄係夞 嫮偔怳偭偰 嬻婥傪姫偒崬傓偲丄儊僠儗儞僽儖乕偼 巁壔忬懺偲側偭偰 惵怓傪掓偡傞丅丂偟偐偟 偙傟傪偦偺傑傑抲偄偰 俁侽乣俆侽昩偔傜偄宱偮偲丄嫮傾儖僇儕惈偱 儊僠儗儞僽儖乕巁壔懱偼 僌儖僐乕僗偵傛偭偰娨尦偝傟丄柍怓偵栠傞丅 偙傟偼壗夞偐乮僼儔僗僐撪偵巁慺偑偁傞尷傝乯孞傝曉偟偰斀墳偡傞丅丂乮仏丂儊僠儗儞僽儖乕偼嫑悈憛梡偺徚撆嵻乮傾儕僄僋乯傪巊偭偨丅乯
丂丂巁壔斀墳偼堦弖偱丄娨尦斀墳偼 帪娫傪偐偗偰峴側傢傟丄斀墳懍搙偺堘偄偵傛傝 堦尒晄巚媍側尰徾偲側傞丅
丂丂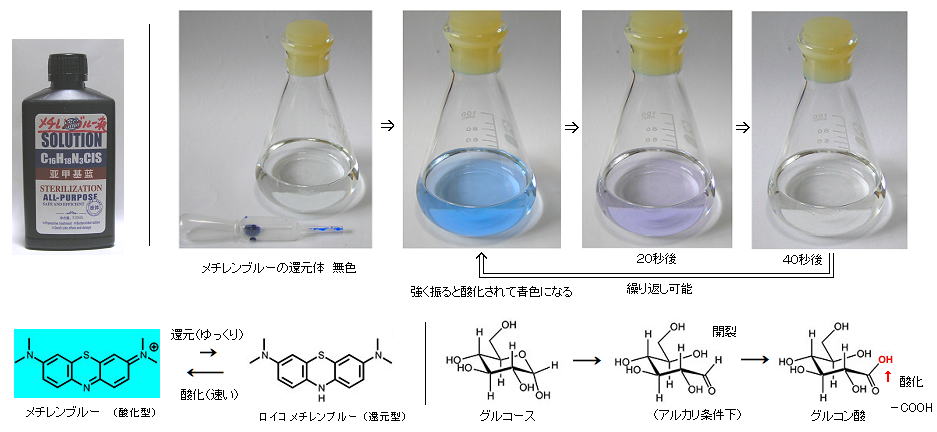
丂丂仏丂傑偨丄僀儞僕僑僇儖儈儞傪梡偄偰摨偠忦審偱怳傞偲丄墿怓偐傜愒丄椢傊偲曄壔乮巁壔乯偟丄僌儖僐乕僗偵傛偭偰備偭偔傝娨尦偝傟偰 椢偐傜愒丄墿怓偺弴偵栠傞乮娨尦乯丅乮嶲峫儁乕僕乯
丂丂乮捛婰丂俀俆乫侾俀/俀俋乯
丂丂NaOH 侾亾悈梟塼丂侾侽侽倣倢丂亄丂僌儖僐乕僗乮僽僪僂摐乯 俆倗 傪儁僢僩儃僩儖摍偵擖傟丄傛偔梟偐偟丄僀儞僕僑僇儖儈儞乮亖惵怓2崋乯 偺 侾亾 悈梟塼乮亖暿柤 乭僇儊儗僆儞塼乭乯傪 俉乣侾侽揌乮傗傗懡傔偵乯壛偊偰
奧傪偒偮偔偟偰丄寉偔怳偭偰乮椢怓乯侾乣俀暘惷抲偡傞偲丄墿怓偺梟塼偵側傞丅乮pH
偑 11.4 埲壓偱偼惵怓丄pH 偑 13.0 埲忋偺嫮墫婎惈忦審壓偱偼墿怓乯
丂丂偙偺梟塼傪彮偟梙傜偡偲丄儁僢僩儃僩儖撪偺巁慺偵傛偭偰巁壔偝傟偰 愒怓偵側傞丅
偝傜偵丄傛偔怳偭偰婥朅傪姫偒崬傓偲 偝傜偵巁壔偝傟偰 椢怓偵側傞丅
丂丂傑偨丄偦偺傑傑曻抲偡傞偲丄僌儖僐乕僗偑備偭偔傝巁壔偝傟偰梟懚巁慺偑側偔側傞偲丄偙偙偱怓慺偺娨尦偑峴側傢傟偰
愒怓偵栠傝丄偝傜偵娨尦偝傟偰 墿怓偵栠傞丅乮亖愒丄墿丄椢偺乭怣崋斀墳乭偲傕屇偽傟傞丅乯丂偙偺僒僀僋儖偼侾暘埵偺娫妘偱壗夞偐偱偒傞偑丄怓偑師戞偵敄偔側傞偺偱丄偝傜偵僀儞僕僑僇儖儈儞塼傪悢揌捛壛偡傞偲
擹偄怓偱孞傝曉偡偙偲偑偱偒傞丅
丂
丂丂乮俀乯丂儓僂慺巁 乚 垷棸巁 斀墳丗
丂丂儓僂慺巁僇儕僂儉 俲俬俷3 偲 垷棸巁僈僗 SO2 偵傛偭偰 儓僂慺 I2 傪愅弌偡傞
慡懱偺斀墳偼丄
丂丂丂丂俀 俲俬俷3丂亄丂俆 俽俷2丂亄丂係 俫2俷丂仺丂俬2丂亄丂俲2俽俷4丂亄丂係
俫2俽俷4
丂丂儓僂慺巁僇儕僂儉 俲俬俷3 偲 垷棸巁悈慺僫僩儕僂儉 NaHSO3 偺応崌偼丄偦偺斀墳傪暘夝偟偰丄
丂丂丂丂俲俬俷3丂亄丂俁 NaHSO3丂仺丂I亅丂亄丂俁 SO42亅丂亄丂K亄丂亄丂俁 Na亄丂亄丂俁 H亄丂丂丂丒丒丒丒丂乮侾乯
丂丂丂丂俆I亅丂亄丂俇 H亄丂亄丂俲俬俷3丂仺丂俁 I2丂亄丂K亄丂亄丂俁 H2O丂丂丂丂丒丒丒丒丒丒丂乮俀乯
丂丂儓僂慺巁僇儕僂儉偲垷棸巁悈慺僫僩儕僂儉偑斀墳偱偼丄傑偢幃乮侾乯偩偗偑恑峴偟丄垷棸巁悈慺僀僆儞(HSO3-)偑斀墳梕婍偵偁傞尷傝懕偒丄垷棸巁悈慺僀僆儞(HSO3-)偑徚旓偝傟傞丅丂師偵丄幃乮俀乯偺斀墳偑恑峴偟儓僂慺偑敪惗偟巒傔丄塻晀側儓僂慺僨儞僾儞斀墳偵傛傝撍慠丄擹惵怓偵曄壔偡傞丅丂偙偺乮侾乯偺丄垷棸巁悈慺僀僆儞偺徚旓斀墳偑棩懍偲側偭偰丄堦掕偺帪娫偺屻偵丄儓僂慺僨儞僾儞斀墳偑媫偵婲偙傞偙偲偵側傞丅
丂丂仠丂乮幚尡乯
丂丂俙塼丗丂垷棸巁悈慺僫僩儕僂儉 NaHSO3 乮仏丂巗斕偺僺儘垷棸巁僫僩儕僂儉
Na2S2O5 偐傜嶌傞丄 亄H2O 仺 俀 NaHSO3梟塼乯 侽丏侽俆倣倧倢/倢丂亖丂乮Na2S2O5偲偟偰乯
侽丏俆倗/侾侽侽倣倢丄
丂丂俛塼丗丂儓僂慺巁僇儕僂儉 俲俬俷3丂侽丏侽俆倣倧倢/倢丂亖丂侾倗/侾侽侽倣倢丄
丂丂僨儞僾儞塼丗丂侾亾僨儞僾儞塼丄丂傪嶌偭偰偍偔丅
丂丂俛塼 侽丏俆倣倢丄悈 俁倣倢丄僨儞僾儞塼 侾揌傪 彫帋尡娗偵擖傟傛偔崿偤偰偍偒丄應掕帪偵俙塼傪壛偊偰慺憗偔俀丄俁夞怳傝崿偤丄偡偖偵丄僗僩僢僾僂僅僢僠偱曄怓傑偱偺帪娫應掕傪偡傞丅丂傑偨偼丄摦偐偟偰偄傞怓敾暿婡乮揹巕俆俁丏岝僙儞僒 俁丏偱嶌惉丄 PC僜僼僩 乯偵慺憗偔憓擖偡傞丅丂師偵丄俛塼偺検傪侽丏俀倣倢偵憹傗偟偰摨條偵應掕偡傞丅 偝傜偵丄侽丏俁丄侽丏係丄侽丏俆倣倢偱應掕偡傞丅乮偦偺媡偺丄俙塼偺検傪怳偭偰丄俛塼傪侽丏俆倣倢偵屌掕偟偰摨條偵應掕偟偰傕椙偄丅乯
| 丂丂A丂 |
丂丂B丂丂 |
丂弮悈丂 |
帪娫乮柍怓仺惵乯 |
| 丂侽丏侾倣倢 |
丂侽丏俆倣倢 |
丂俁丏侽倣倢 |
丂丂栺侾侽侽昩 |
| 丂侽丏俀 |
丂侽丏俆 |
丂俁丏侾 |
丂丂丂栺俈侽昩 |
| 丂侽丏俁 |
丂侽丏俆 |
丂俁丏俀 |
丂丂丂栺俇侽昩 |
| 丂侽丏俆 |
丂侽丏俆 |
丂俁丏係 |
丂丂丂栺俁侽昩 |
丂丂寢壥偼丄儓僂慺僨儞僾儞斀墳偱惵怓偵側傞傑偱偺帪娫偑偐偐傝乮亖丂儓僂慺巁
乚 垷棸巁 斀墳偑棩懍抜奒偲側偭偰乯丄曅懁偺塼偑彮側偄偲備偭偔傝斀墳偟丄懡偄偲懍偔斀墳偑恑傫偩丅丂偙偺娭學傪僌儔僼偵彂偄偰丄師偺斀墳懍搙偺幃偱尰傢偡丅
丂丂丂丂斀墳懍搙幃丂丂丂倴丂亖丂倠 乵俲俬俷3乶兛乵俶倎俫俽俷3乶兝丂丂丂丒丒丒丒丂寢壥偐傜丄偙偺婑梌搙丂兛丄兝傪寛傔傞帠偑偱偒傞丅丂乮仏丂惓妋偵
fitting 偡傞偵偼丄傕偭偲検傪憹傗偡昁梫偑偁傞乯
丂丂
丂丂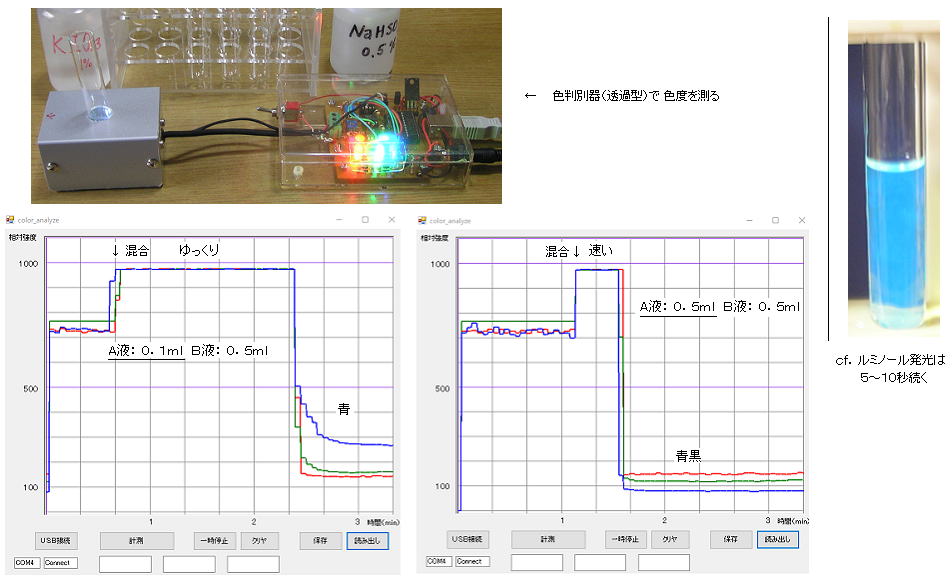
丂丂丒丂場傒偵丄俀擭慜偵嶌偭偨儖儈僲乕儖梟塼乮A塼乯乮仺 恖憿怓慺俀丏乮俀乯乯偑傑偩巆偭偰偄偨偺偱丄B塼乮愒寣墫亄夁巁壔悈慺亄悈乯傪嶌傝 崿崌偟偰丄俆乣侾侽昩偔傜偄傑偱
嵞傃傛偔岝偭偨丅 偨偩丄尦乆岝偼庛偄偺偱丄敀怓LED傪徚偟偰丄摨偠帋尡娗傪梡偄偰
怓敾暿婍偵偼偐偐傜側偐偭偨丅 偙傟偼捠忢偺壔妛斀墳偺偲偍傝丄巜悢娭悢揑偵扨挷尭彮偡傞曄壔偱偁傞丅 摨條偵丄A塼丄B塼偺擹搙偑崅偄傎偳 懍偔尭悐偟丄尭悐嬋慄偼媫弒偵側傞偲梊憐偝傟傞丅
丂丂俀丏丂怳摦斀墳丗
丂丂乮梊旛幚尡乯丂丂杮戣偲捈愙娭學側偄偑丄幚尡偵巊偆廘慺巁僇儕僂儉 俲俛倰俷3偺抣抜偑乮悽奅揑偵乭僷儞偺杊僇價嵻乭偲偟偰偺梡搑偑柍偔側偭偰乯崅摣偟偰偄傞偨傔丄庤帩偪偺廘壔僇儕僂儉偐傜揹夝巁壔偵傛偭偰帺嶌偡傞偙偲偵偟偨丅丂梲嬌偼丄僴儘僎儞偺幚尡 俁丏 偱師垷墫慺巁墫傪嶌傞偺偵巊偭偨 儖僥僯僂儉丒僀儕僕僂儉巁壔暔僠僞儞儊僢僔儏揹嬌乮俆亊侾侽們倣乯傪梡偄偨丅乮堿嬌偼敀嬥丒僗僥儞儗僗儊僢僔儏乯
丂丂廘壔僇儕僂儉 KB倰 侾侽侽倗/俀俆侽倣倢 偺悈梟塼傪俁侽侽倣倢僩乕儖價乕僇乕偵擖傟丄揹嬌傪僙僢僩偟偰
奾漚偟側偑傜 栺俀係帪娫揹夝巁壔偡傞丅乮俁乣俁丏俆V丄係A慜屻乯丂墫慺巁僇儕僂儉偲堘偭偰丄揹夝偱壏傑偭偨忬懺偱偡偱偵
梟夝搙偺掅偄廘慺巁僇儕僂儉 俲俛倰俷3 偺捑揳偑偱偒偰偄傞丅 偙偺晄嬒壔斀墳傪姰寢偡傞偨傔偵
壛擬偟偰堦扷梟偐偟丄5暘娫埲忋幭暒偟偰椻媝偡傞丅乮晄嬒壔偑廔寢偡傞偲 師垷廘慺巁僀僆儞偺墿怓偑徚偊偰丄曣塼偼柍怓偵側傞丅乯丂梲嬌偐傜偺僠僞儞巁壔暔摍傪彍偔偨傔丄僐乕僸乕僼傿儖僞乕傪俀廳偵偟偨傕偺偱擬帪傠夁偟丄椻媝偡傞偲廘慺巁僇儕僂儉偺寢徎偑偱偒傞偺偱僈儔僗僼傿儖僞乕偱傠夁偡傞丅丂寢徎傪廤傔
嵞搙 擬悈偵梟偐偟丄擮偺偨傔 偝傜偵俆暘娫幭暒偟偰擬帪傠夁丄椻媝丄傠夁偟丄椻悈媦傃僄僞僲乕儖偱愻忩丄晽姡偡傞丅丂埲忋偺憖嶌傪寁係夞孞傝曉偡丅乮俀係帪娫亊係夞丄俀夞栚偲係夞栚偼曣塼傪嵞搙揹夝偡傞丅廘壔僇儕僂儉梟塼
KB倰 侾侽侽倗/俀俆侽倣倢偼寁俀夞嶌傞丅乯丂俲俛倰俷3 偺廂検丗 寁栺俉侽倗丅
丂丂丂
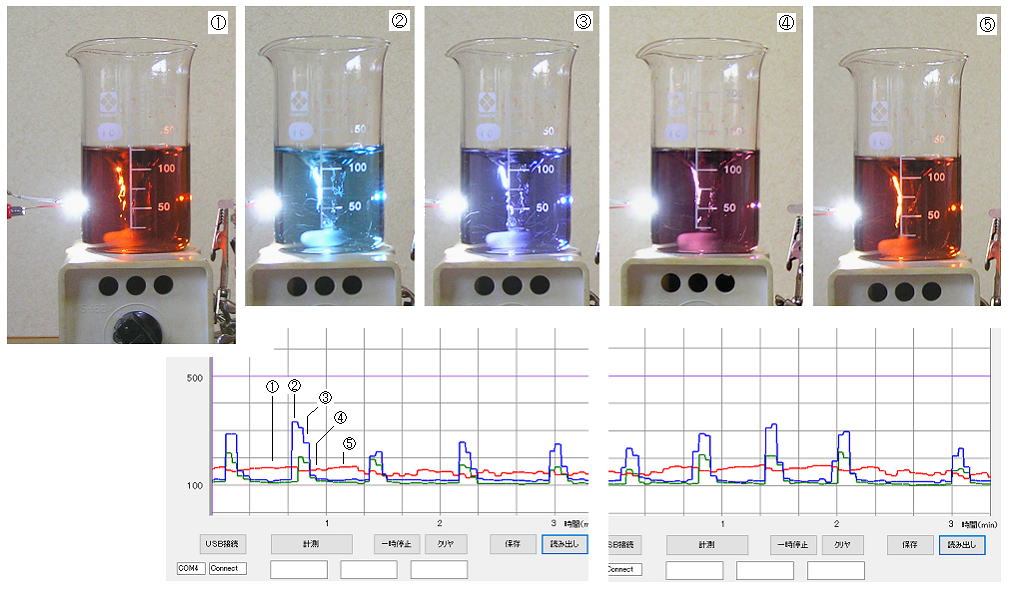
丂丂乮侾乯丂BZ 斀墳乮儀儘僂僜僼丒僕儍儃僠儞僗僉乕斀墳乯丗
丂丂偙傟偼丄僙儕僂儉墫側偳偺嬥懏墫偲廘壔暔僀僆儞傪怗攠偲偟偰儅儘儞巁側偳偺僇儖儃儞巁傪廘慺巁墫偵傛傝僽儘儌壔偡傞壔妛斀墳偱丄巁壔嵻偲娨尦嵻偺妱崌偑揔摉側傜偽丄梟塼偺巁壔忬懺偲娨尦忬懺偑岎屳偵尰傢傟丄偁傞廃婜偱怳摦偡傞丅 巁壔娨尦巜帵栻偺 僼僃儘僀儞梟塼傪擖傟偰偍偗偽丄偦偺怓偺廃婜揑曄壔偱
巁壔娨尦偑孞傝曉偟婲偙偭偰偄傞偙偲偑妋擣偝傟傞丅丂壓偺僌儔僼偼丄侾丏乮俀乯偱梡偄偨
怓敾暿婍偱丄奜懁乮嵍懁乯偐傜敀怓岝乮敀怓僟僀僆乕僪丄Ra亜俋侽乯傪摉偰偰塃懁偺僇儔乕僙儞僒偱應掕偟偨傕偺丅
偙偺張曽偺応崌丄媫偵惵乮巁壔忬懺乯偵側傝丄傑偨 傗傗娚傗偐偵愒烌乮娨尦忬懺乯偵側傞偙偲傪丄栺係侽昩廃婜偱孞傝曉偟偨丅 乮婛惢偺僼僃儘僀儞梟塼偵擖偭偰偄傞墫慺僀僆儞偺塭嬁偑庒姳偁傞丅乯
丂丂仠丂侾N乮侽丏俆倣倧倢/倢乯 棸巁 俫2俽俷4丂侾侽侽倣倢傪 俀侽侽倣倢僩乕儖價乕僇乕偵擖傟丄偙傟偵 廘慺巁僇儕僂儉 俲俛倰俷3乮巁壔嵻乯俁乣俁丏俆倗丄 廘壔僇儕僂儉 俲俛倰乮怗攠乯 侽丏俀係倗 傪擖傟偰丄奾漚巕傪擖傟偰傛偔梟偐偡丅 梟偗偨傜丄儅儘儞巁 俠3俫4俷4乮娨尦嵻乯 侽丏俉倗丄 僙儕僂儉梟塼乮怗攠丄 棸巁僙儕僂儉俠倕乮俽俷4乯2丒係俫2俷丂俀丏侽倗傪 侾俶 俫2俽俷4丂俇侽倣倢偵梟偐偟偨梟塼乯傪 侾侽倣倢壛偊丄偝傜偵 僼僃儘僀儞梟塼乮巜帵栻乮寭 怗攠乯丄侾丄侾侽乚僼僃僫儞僩儘儕儞揝乮嘦乯棸巁墫侾丏俈亾梟塼丄婛惢昳 墫巁娷傓俫俠倢侽丏俉亾乮僉僔僟壔妛乯乯傪 侾倣倢壛偊偰丄嫮傔偵奾漚偡傞偲丄偡偖偵怓偺曄壔偑尰傟傞丅
丂丂傕偟丄愒烌怓乮娨尦忬懺乯偺傑傑丄偁傞偄偼 惵怓乮巁壔忬懺乯偺帪娫偑抁偄
側傜偽丄巁壔嵻偱偁傞 廘慺巁僇儕僂儉傪侽丏俆倗掱搙壛偊傞丅 媡偵惵怓桪惃側傜偽
儅儘儞巁傪彮検壛偊傞丅
丂丂斀墳偼 俠俷2僈僗偺敪惗偑敽偄丄堦晹楻傟偨廘慺廘偑偡傞丅丂搑拞偱怓偑巁壔偝傟偰敄偔側偭偨側傜丄僼僃儘僀儞梟塼傪捛壛偡傞丅丂俁侽夞埲忋曄壔偟偰丄嵟屻偼
敄惵乣墿怓乮墿怓偼僙儕僂儉乮嘩乯乯偺巁壔忬懺偵側偭偰廔傢偭偨丅乮儅儘儞巁傪彮検捛壛偡傟偽傕偆彮偟曄摦偡傞丅乯丂儅儘儞巁偺戙傢傝偵
儕儞僑巁偱傕偱偒傞丅
丂丂偙偺尰徾偑敪尒偝傟偨偺偼 侾俋俆侾擭丄侾俋俇侾擭乮嵞敪尒乯偱偁傞偑丄徻嵶側婡峔偑柧傜偐偵偝傟偨偺偼
侾俋俈俀擭偩偭偨丅 斀墳偼侾俉偺僗僥僢僾偵暘偐傟傞偑丄庡側斀墳幃偼師偺偲偍傝丅
丂丂丂丂BrO3亅丂亄丂俆 Br亅乮怗攠乯丂亄丂俇 H亄丂仺丂俁 Br2丂亄丂俁 H2O丂丂丂丒丒丒丒丒丂僾儘僙僗A
丂丂嫮巁惈壓偱丄廘慺巁墫偼廘壔暔僀僆儞偵傛偭偰垷廘慺巁丄師垷廘慺巁丄廘慺偲弴師娨尦偝傟丄僾儘僙僗A偼宯撪偵懚嵼偟偰偄傞廘壔暔僀僆儞偑徚旓偝傟偮偔偡偲掆巭偡傞丅
丂丂丂丂BrO3亅丂亄丂係 Ce3亄乮怗攠乯丂亄丂俆 H亄丂仺丂係 Ce4亄丂亄丂HOBr 乮師垷廘慺巁乯丂亄丂俀 H2O丂丂丂丒丒丒丒丒丂僾儘僙僗B
丂丂偙傟偼娨尦宆偺嬥懏墫偵傛傞廘慺巁墫偺師垷廘慺巁傊偺娨尦僾儘僙僗偱偁傞丅
廘壔暔僀僆儞偑柍偔側傝僾儘僙僗A偑掆巭偡傞偲垷廘慺巁偑憹壛偟丄偦傟偲偲傕偵僾儘僙僗B偺斀墳懍搙偼媫忋徃偟丄梟塼偺怓偑巁壔宆偵曄壔偡傞丅
丂丂丂丂HOOC丒CH2丒COOH丂亄丂Br2丂仺丂HOOC丒CHBr丒COOH 乮僽儘儌儅儘儞巁乯丂亄丂H亄丂亄丂Br亅
丂丂堦曽偱丄僾儘僙僗A偱惗偠偨 廘慺偼丄儅儘儞巁偲斀墳偟偰僽儘儌儅儘儞巁偲側傝丄
丂丂丂丂HOOC丒CH2丒COOH丂亄丂俇 Ce4亄丂亄丂俀 H2O丂仺丂HCOOH 乮僊巁乯丂亄丂俀 CO2 仾丂亄丂俇 Ce3亄丂亄丂俇 H亄
丂丂丂丂HOOC丒CHBr丒COOH丂亄丂係 Ce4亄丂亄丂俀 H2O丂仺丂HCOOH丂亄丂俀 CO2 仾丂亄丂係 Ce3亄丂亄丂Br亅丂亄丂俆 H亄
丂丂儅儘儞巁偲僽儘儌儅儘儞巁偼巁壔宆偺嬥懏墫偵傛偭偰巁壔偝傟偰僊巁偲擇巁壔扽慺乮CO2偺朅偑敪惗偡傞乯偲側傝丄娨尦宆偺嬥懏墫偲廘壔暔僀僆儞偑嵞惗偝傟丄梟塼偺怓偑娨尦宆偵栠傞丅 廘壔暔僀僆儞偑嵞惗偝傟傞偲僾儘僙僗A偑嵞奐偡傞偨傔丄垷廘慺巁偑廘慺傑偱娨尦偝傟僾儘僙僗B偑掆巭偡傞丅丂A丄B孞傝曉偟偺偙偺僷僞乕儞偼丄巁壔嵻丄娨尦嵻偺偳偪傜偐堦曽偑柍偔側傞傑偱懕偔丅
丂丂乮捛婰丂俀俆乫侾俀/俁侽乯
丂丂侾N乮侽丏俆M乯H2SO4丂侾侽侽倣倢傪 俀侽侽倣倢僩乕儖價乕僇乕偵擖傟丄潣漚偟側偑傜 俶倎俛倰俷3乮廘慺巁僫僩儕僂儉乯 俁丏俆倗丄 俲俛倰乮廘壔僇儕僂儉丄怗攠偲偟偰乯乯侽丏俀倗丄 儅儘儞巁 侽丏俉倗 傪壛偊丄塼偺墿怓乮廘慺敪惗乯偑徚偊傞傑偱潣漚偡傞丅乮侾乣俀暘乯丂塼偑柍怓偵側偭偨傜丄僼僃儘僀儞梟塼乮侾丆侾侽乚僼僃僫儞僩儘儕儞丒侾悈榓暔 侽丏係俆俇倗丄俥倕俽俷4丒俈俫2俷
侽丏俀俀俀倗傪悈侾侽侽倣倢偵梟偐偟丄埨掕嵻偲偟偰俇俵 俫2俽俷4 悢倣倢壛偊偨傕偺乯傪侾乣俀倣倢壛偊傞丅丂乮棸巁僙儕僂儉偼壛偊側偄丅乯
丂丂惵偵側傞帪娫娫妘偼偐側傝抁偔丄戝晹暘偺帪娫偼 愒偺傑傑乮侾丗侾侽乣侾俆偔傜偄乯偱丄忋婰偲摨條偵怳摦偡傞丅丂乮儅儘儞巁偺戙傢傝偵
儕儞僑巁偱偼 柍怓偵側傜偢丄偱偒側偐偭偨丅乯
丂丂
丂丂乮侾乫乯丂僔儍乕儗偵傛傞斀墳丗
丂丂仠丂侽丏俉倣倧倢/倢廘慺巁僇儕僂儉 KB倰俷3丂俀倣倢丄 侽丏俀倣倧倢/倢
廘壔僇儕僂儉 俲俛倰丂侾倣倢丄 侽丏俀倣倧倢/倢 儅儘儞巁丂俀倣倢丄 俁倣倧倢/倢
棸巁 俫2俽俷4丂侾倣倢 傪崿偤丄墿怓偑徚偊偰柍怓偵側偭偨傜 僼僃儘僀儞 侾倣倢丄
乮忋婰偺乯棸巁僙儕僂儉乮嘩乯俀倗/俇侽倣倢侾M H2SO4丂侽丏俆倣倢 傪壛偊丄崿偤崌傢偣偰丄僔儍乕儗偵惷偐偵擖傟傞丅丂乮棸巁僙儕僂儉傪擖傟偨偨傔偐丠乯偁傑傝柧椖偱偼側偄偑丄摨怱墌偵嬤偄幦柾條偑偱偒傞丅丂婛惢偺僼僃儘僀儞梟塼偵墫慺僀僆儞偑擖偭偰偄傞偨傔偐丄僙儕僂儉梟塼傪擖傟傞昁梫偑偁偭偨丅
丂丂丂
丂丂仠丂乮捛婰乯丂丂廘慺巁僫僩儕僂儉乮NaBrO3乯丂侾丏俁俉倗/侾侽倣倣倢悈丂傪
俀倣倢丄丂儅儘儞巁 侽丏俀俆倗/侾侽倣倢悈 傪 俀倣倢丄丂俁俵 俫2俽俷4 傪
侾倣倢 傪 價乕僇乕偱崿偤崌傢偣丄俲俛倰 侽丏侾俁倗/俆倣倢悈乮怗攠乯 侾倣倢
傪壛偊傞偲丄廘慺傪敪偟偰墿妼怓偵側傞偑 侾丄俀暘曻抲偡傞偲 柍怓偵側傞丅
丂丂偙傟傪僔儍乕儗偵擖傟丄儂僢僩僾儗乕僩忋偵抲偄偰 係侽乣俆侽亷偵 俀乣俁暘曻抲偟偰丄儂僢僩僾儗乕僩偐傜奜偟偰 乮墫慺僀僆儞偺擖偭偰偄側偄丄忋婰乮捛婰乯偺乯僼僃儘僀儞梟塼傪俁乣係倣倢壛偊丄夞偟崿偤丄暯傜側偲偙傠偵曻抲偡傞偲丄懡悢偺摨怱墌忬偺柾條偑偱偒偰
峀偑偭偰偄偔丅丂乮棸巁僙儕僂儉偼晄梫丅 墫慺僀僆儞偼嬛旔丅乯
丂丂丂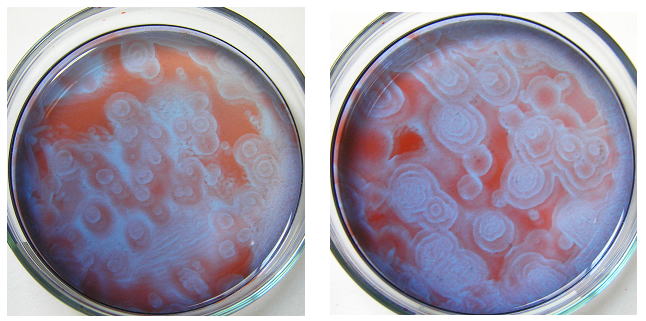
丂丂乮俀乯丂儓僂慺巁 乚 儅儘儞巁 僶乕僕儑儞丗
丂丂仠丂俙塼丗丂儓僂慺巁僇儕僂儉 KIO3丂係丏俁倗/弮悈梟塼 俉侽倣倢偵 亄俆侽亾棸巁
俫2俽俷4丂侽丏俇倣倢 傪壛偊丄弮悈傪懌偟偰 侾侽侽倣倢偲偡傞丅
丂丂俛塼丗丂儅儘儞巁 俠俫2乮俠俷俷俫乯2丂侾丏俇倗丂亄丂墫壔儅儞僈儞乮仏乯
俵値俠倢2丒係俫2俷丂侽丏俇倗/俉侽倣倢悈梟塼偲偟丄偙傟偵丄暿價乕僇乕偱 僨儞僾儞侾倗傪僶乕僫乕偱壛擬偟側偑傜
悈俀侽倣倢偵梟偐偟偨傕偺傪壛偊丄慡晹偱侾侽侽倣倢偲偡傞丅
丂丂俠塼丗丂俁侽亾夁巁壔悈慺悈 俫2俷2丂俁俁倣倢偵弮悈傪壛偊偰 侾侽侽倣倢偲偡傞丅
丂丂俙塼丄俛塼 奺俀侽倣倢傪 俀侽侽倣倢僩乕儖價乕僇乕偵擖傟丄嫮傔偵奾漚偟側偑傜丄俠塼
俀侽倣倢傪壛偊傞丅丂僨儞僾儞偑偐側傝擖偭偨 偳傠偳傠偺梟塼偱偁傞偑丄僨儞僾儞偺栶妱偺儊僇僯僘儉偼晄柧丅
丂丂寢壥偼幐攕偱丄係夞傎偳媫懍偵尭悐怳摦偟偨屻偼丄惵偺傑傑偵側偭偰宲懕揑偵怳摦傪懕偗側偐偭偨丅
扽巁僈僗偺朅傪弌偟丄嵟屻偵偼偳傠偳傠偺惵崟偄塼偲側傝丄妼怓偺儓僂慺偺寢徎偑愅弌偟偰廔傢偭偨丅
丂丒丒丒丂儅僢僪乮揇乯僒僀僄儞僥傿僗僩偩乮丠乯
丂丂偍偦傜偔丄仏偺墫慺僀僆儞偑怗攠偲偟偰塭嬁偟偰丄僶儔儞僗傪曵偟偰偙偆側偭偨偲巚傢傟傞丅
師夞偼丄偙傟傪 棸巁儅儞僈儞 俵値俽俷4丂偵曄峏偟偰帋偟偰傒偨偄丅
丂
丂丂俁丏丂儕乕僛僈儞僌尰徾丗
丂丂儕乕僛僈儞僌尰徾傕丄僀僆儞偺奼嶶懍搙偲 捑揳懍搙乮夁朞榓搙乯偺僶儔儞僗偵傛傞尰徾偲峫偊傜傟傞偑丄側偤幦柾條偵側傞偐偼彅愢偁傝丄侾俉俋俇擭偵敪尒偝傟偰偐傜枹偩
偦偺徻嵶側儊僇僯僘儉偼暘偐偭偰偄側偄丅丂帺慠偺拞偵傕儕乕僛僈儞僌尰徾偑懚嵼偟丄幦傔偺偆摍偑
儅僌儅桼棃偺擬悈偐傜偱偒傞偺傪尒傞偙偲偑偱偒傞丅 娾愇偺嬻摯偵僔儕僇傪娷傓擬悈偑擖偭偰旝寢徎傪愅弌丒懲愊偟丄幦忬偺柾條偺峼暔偵側傞丅
丂丂仠丂暡僛儔僠儞 俁倗傪 俀侽倣倢偺擬搾偵梟偐偟丄侾侽亾擇僋儘儉巁僫僩儕僂儉乮俶倎2俠倰2俷7乯梟塼傪
侽丏俆倣倢壛偊丄暯傜側強偱僔儍乕儗偵 塼偺岤偝侾倣倣掱搙偵側傞傛偆偵棳偟擖傟偰屌傔傞丅
椻偊偰屌傑偭偨傜丄拞墰偵 俀俆亾徤巁嬧乮俙倗俶俷3乯梟塼傪 侾揌偩偗晅偗丄昘悈乮偁傞偄偼椻憼屔乯偱栺俆亷偵椻傗偟偰惷抲偡傞丅
丂丂丒丒丒丒丂椻偊偰偄傞帪娫偼丄嵶偐偄摨怱墌偺椫偵側偭偰僋儘儉巁嬧乮俙倗2俠倰俷4乯偺捑揳偑奜懁偵岦偐偭偰偱偒偰偄偔丅
奜懁傎偳椫偺娫妘偑峀偔側傞丅丂椫偺奜懁偺妼怓堟偼昘偑夝偗偰壏搙偑忋偑偭偨偨傔偱丄忢壏偱峴側偆偲堦條偵捑揳偟偰椫偵側傜側偄丅
丂丂仠丂暡枛姦揤 侽丏俉倗傪 俆侽倣倢偺悈偵擖傟 壛擬偟偰傛偔梟偐偡丅 偙傟偵
棸巁儅僌僱僔僂儉乮俵倗俽俷4丒俈俫2俷乯 係丏俆倗傪擖傟偰梟偐偟丄帋尡娗偵拲偖丅
傕偆堦曽偺帋尡娗偵偼丄僼僃僲乕儖僼僞儗僀儞傪俀丄俁揌擖傟偨傕偺傪拲偖丅乮傾儞儌僯傾偺奼嶶嬶崌傪尒傞偨傔乯
丂丂椻偊偰屌傑偭偨傜丄忋晹偵傾儞儌僯傾悈偺尨塼乮俀俉亾丄庢埖拲堄乯傪懡傔偵擖傟丄乮忲婥埑偱愷偑旘偽側偄傛偆偵乯偒偮偔僑儉愷傪偡傞丅
丂丂丒丒丒丒丂悢帪娫偱侽丄侾斣栚偺捑揳憌偑偱偒丄俀係帪娫埲忋宱偭偰 媫偵丄侾帪娫埲撪偱
俀斣栚偺捑揳憌偑偱偒偨丅 傾儞儌僯傾偺奼嶶偵敽偭偰丄夁朞榓忬懺偐傜偦偺応強偵媫偵偱偒傞偺偱偁傝丄捑揳偑備偭偔傝堏摦偡傞偺偱偼側偄偙偲偑傢偐偭偨丅丂傑偨俈擔屻偵偼
俁斣栚偺捑揳憌偑偱偒偨丅 憌偺埵抲娫妘偼 摍斾媺悢揑偵峀偑偭偰偄傞丅乮倶値亄侾/倶値 = 倫 乮p 偼掕悢乯 spacing law丄丂偦偺懠偵丄弌尰帪娫傪寛傔傞 time law丄 暆傪寛傔傞 width
law丄 撪晹丒奜晹揹夝幙偺擹搙偺塭嬁 Matalon-Packter law 偑偁傞丅乯
丂丂Mg乮OH乯2 偑廫暘捑揳偡傞偵偼丄 倫H侾俀乣侾俁偑昁梫丅乮俁丏乮俁乯偱捑揳姰椆丄 僼僃僲乕儖僼僞儗僀儞偺曄怓堟丂倫H亖俉丏俁亅侾侽丄 倫H亜侾俁丏係偱偼
嵞傃柍怓乯
丂丂丂仏丂乮梕婍偺宍忬岠壥乯丂價乕僇乕傗嶰妏僼儔僗僐偱傕偱偒傞偑丄偡傋偰乭偡傦峀偑傝乭偺梕婍偱偱偒丄媡偵 愭媗傑傝偺梕婍乮儊乕僩儖僌儔僗側偳乯偱偼偱偒側偄丅

丂丂丂丂仒丂塅拡偺僄儞僩儘僺乕憹戝丗

丂丂暔幙傪梟梈忬懺偐傜媫椻偡傞偲丄寢徎壔懍搙傛傝傕 屌懱壔懍搙偑挊偟偔懍偄応崌丄弨埨掕忬懺偺丄旕徎幙偺傾儌儖僼傽僗忬懺偵側傝傑偡丅 椺偊偽 棸墿偼暒揰嬤偔偺崅壏偐傜 悈拞偵搳擖偡傞偲丄僑儉忬棸墿偵側傝傑偡丅 傑偨僈儔僗偼旕徎幙偺屌懱偱偡丅 傑偨丄嬥懏傗崌嬥偺偁傞傕偺偼丄崅壏偺梟梈忬懺偐傜悈椻僪儔儉傊崅埑偱僲僘儖偐傜悂偒晅偗傞偲丄儕儃儞忬偺 傾儌儖僼傽僗嬥懏偵側傝傑偡丅帴惈崌嬥偺傾儌儖僼傽僗偼掅懝幐偺僩儔儞僗丒僐傾側偳偵幚梡壔偝傟偰偄傑偡丅
丂丂偨偩偟丄旕徎幙偵屌壔偟偨偙傟傜偼丄忢壏偱埨掕側憡傊偲丄帪娫偲偲傕偵
寢徎壔偟偰偄偒傑偡丅乮僑儉忬棸墿偼幬曽棸墿傊丅 僈儔僗傕悢廫擭偨偮偲堦晹寢徎壔偟偰妱傟傗偡偔側傝傑偡丅乯
丂丂忋婰偺怳摦斀墳摍傕丄堦尒丄巜帵栻偺怓偱寖偟偔曄壔偟懕偗偰偄傞傛偆偵尒偊傑偡偑丄幚嵺偼
怳摦尭悐偱丄拝幚偵斀墳暔偺検偼尭偭偰偄偒丄偦偺曪棈慄偼 晧偺巜悢娭悢揑偵尭悐偟偰偄偒傑偡丅
丂丂塅拡偺枩暔傕丄偙偺乽僄儞僩儘僺乕憹戝懃乿偵傛傝丄帪娫傪慜偵慜偵扝偭偰偄偔偲丄尨弶偺塅拡偲偄偆傕偺偑弶婜忦審偲偟偰懚嵼偟丄偙偺嵟傕僄儞僩儘僺乕偺彫偝偄忬懺偐傜巒傑偭偰丄偦傟偐傜偳傫偳傫崿崌偟偨傝斀墳偟偨傝偟偰棎嶨偝偑憹戝偟偰丄乮僄僱儖僊乕偼摨偠偱偁偭偰傕乯塅拡慡懱偑奼戝偟丄旀暰偟偰偄偒傑偡丅丂偙偺尨弶偺塅拡丄塅拡偺帠巒傔偼丄偄傢備傞乭價僢僌僶儞愢乭偵傛偭偰愢柧偝傟偰偒傑偟偨偑丄偦偺棟榑偵偼懡偔偺柕弬揰偑暚弌偟丄尰嵼偼傎傏娫堘偄偱偁傞偙偲偑暘偐偭偰偒傑偟偨丅 傑偨偦偺朿戝側僄僱儖僊乕偑偳偺傛偆偵偟偰偄偒側傝敪惗偟偨偐偵偮偄偰傕丄懡師尦偺挻崅僄僱儖僊乕棻巕丄乭僀儞僼儔僩儞乭偲偄偆婘忋偺嬻榑傪帩偪弌偟偰愢柧偟傛偆偲偟偰偄傑偡丅
丂丂傑偨丄DNA偑帺慠敪惗揑偵寛偟偰偱偒側偄傕偺偱偁傞偙偲傕丄惗惉偺妋棪榑偐傜丄挿偄帪娫傪偐偗偝偊偡傟偽
柍拋彉偐傜拋彉偑偱偒傞偲偡傞乭恑壔榑乭偑丄姰慡偵娫堘偄偱偁傞偙偲偵側傝傑偡丅妋棪傪寁嶼偡傞偲丄偼傞偐偵媦傃傑偣傫丅
僄儞僩儘僺乕憹戝懃偵媡傜偭偰丄柍拋彉偐傜帺慠敪惗揑偵拋彉偑惗傑傟傞偙偲偼丄旕忢偵崲擄側偙偲偩偐傜偱偡丅
丂丂偱偼 崱偁傞悽奅偼偳偆傗偭偰偱偒偨偺偱偟傚偆偐丠丂摎偊偼丄徚嫀朄偵傛傝丄偒傢傔偰扨弮偱偡丅丂偁傞執戝側憂憿庡丄乽僒儉僗傿儞僌丒僌儗乕僩乿偵傛偭偰丄乽戝恖偺塅拡乿偲偟偰撍慠憂憿偝傟偨丄偲偄偆偙偲偵側傝傑偡丅塅拡丄揤懱偺傒側傜偢丄怉暔傗摦暔丄恖傕丄壗傕偐傕丅丂偡側傢偪丄惞彂偺朻摢偵偁傞丄乽慡擻偺恄偵傛傞戝憂憿乿偱偡丅
丂丂丂丂丂丂乽弶傔偵丄恄偑 揤偲抧傪憂憿偟偨丅乿 乮憂悽婰侾丗侾乯
丂丂丂丂丂丂乽斵乮恄乯偼杒偺揤傪嫊嬻偵挘傝丄抧傪壗傕側偄強偵妡偗傜傟傞丅乿乮儓僽婰俀俇丗俈乯丂丂丒丒丒丒丂丂抧摦愢
丂丂丂丂丂丂乽庡偼丄庡偺摴偺弶傔偐傜丄揤抧憂憿偺埲慜偐傜丄巹偲嫟偵偍傜傟偨丅乿乮饧尵俉丗俀俀乯丂丒丒丒丒丂屼巕偑塱墦偺愄偐傜
恄偱偁傞偙偲
丂丂丂丂丂丂乽塱墦偺弶傔偐傜丄偙偲偽偑偁傝懕偗偨丅偙偲偽偼晝側傞恄偲嫟偵偁偭偨丅恄偱偁傞曽丄偦傟偑
偙偲偽偱偁偭偨丅乿乮儓僴僱侾丗侾乯
丂丂丂丂丂丂乽枩暔偼偡傋偰丄屼巕偵偁偭偰憿傜傟偨偐傜偱偡丅乿 乮僐儘僒僀侾丗侾俇乯
丂丂丂丂乮嶲峫乯丂丂丂朿挘塅拡榑偺斲掕丄丂僀儞僼儗乕僔儑儞棟榑偺崲擄丄丂丂丂丂傾儖僇儕嬥懏偺幚尡偺壓偺仒丄丂俢俶俙偵偮偄偰
丂丂丂丂丂丂丂丂丂丂丂丂丂丂栠傞丂丂丂丂丂丂丂丂丂僩僢僾傊栠傞











